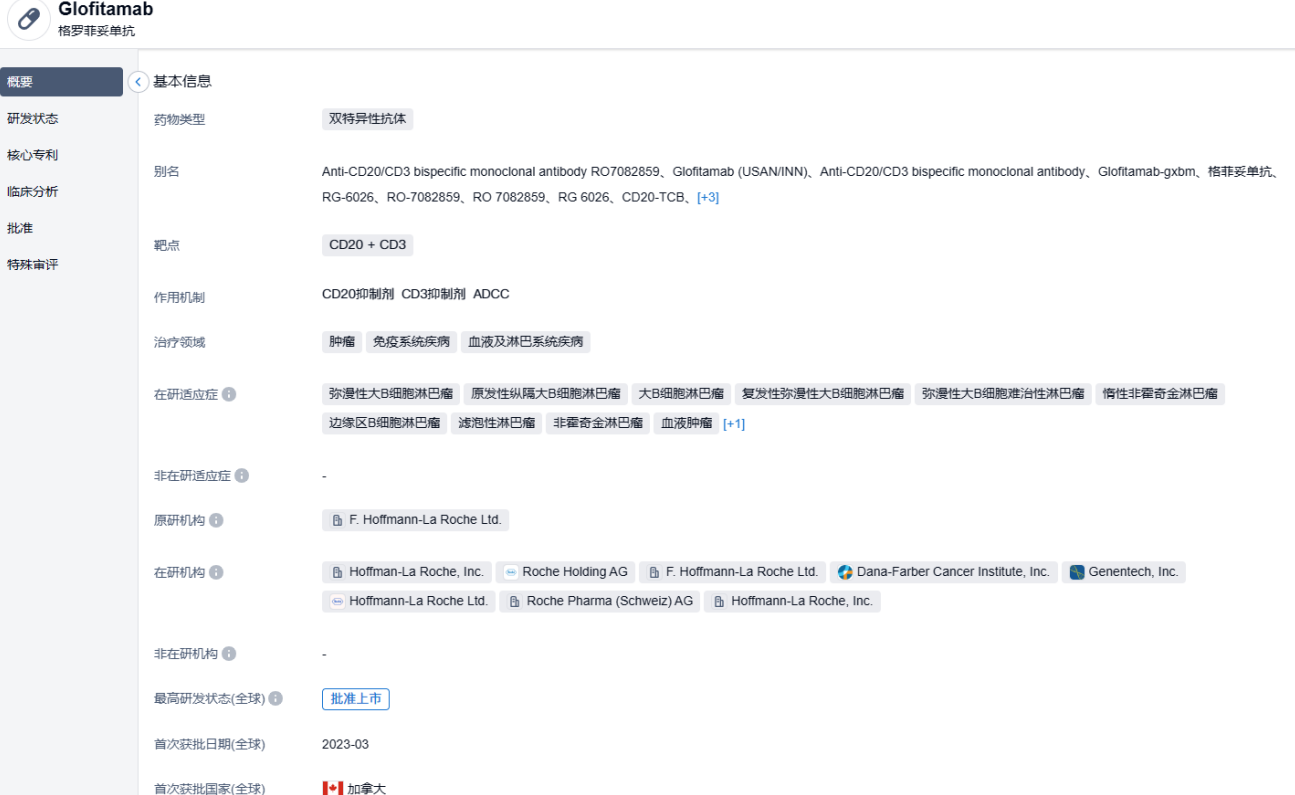
2023年6月15日,罗氏(Roche)旗下基因泰克(Genentech)宣布,美国FDA已批准Columvi(Glofitamab-gxbm)用于复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)或由滤泡性淋巴瘤引起的大B细胞性淋巴瘤(LBCL)成年患者的治疗,这些患者经过二线或多线的系统治疗。
Columvi(Glofitamab-gxbm)是一款能够同时靶向CD3与CD20的双特异性抗体。Glofitamab的特别之处在于,作为一个抗体,它的两条臂并不一样,一侧的Fab段是中规中矩的CD20结合位点,而另一侧则是将一个抗CD20 Fab和一个抗CD3 Fab柔性头尾相接,即具有2:1比例的CD20和CD3结合位点。抗CD20 Fab抓牢癌细胞,抗CD3 Fab找T细胞,独特的抗体结构设计使Glofitamab相比1:1结构的TCB具有更强的B细胞抓取能力,可诱导更紧密和稳定的T细胞-癌细胞免疫突触。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
FDA此次加速批准是基于Columvi在1/2期NP30179研究中的积极结果,该研究在132例既往治疗后复发或难治的DLBCL患者中开展,包括约三分之一既往接受过CAR-T细胞治疗的患者。此外,83%的患者在近期治疗中属于难治类型。该试验结果指标包括独立审评委员会评估的完全缓解率(主要终点),以及总缓解率、缓解持续时间、无进展生存期、安全性和耐受性(次要终点)。结果显示,接受Columvi固定持续时间治疗的患者获得了持久缓解,56%(74/132)的患者获得了总体缓解(OR),43%的患者获得了完全缓解(CR)。超过三分之二的应答者持续应答至少9个月。总缓解率是完全缓解率(癌症的所有体征和症状消失)与部分缓解率(体内癌症量减少)之和。中位缓解持续时间为1.5年(18.4个月)。NP30179研究的数据已于近期发表在《新英格兰医学杂志》上。临床试验证明,Columvi可以为复发性或难治性弥漫性大B细胞淋巴瘤患者提供一个通过固定持续时间免疫疗法获得完全缓解的机会,并且这种缓解可以在其治疗结束后潜在地持续。
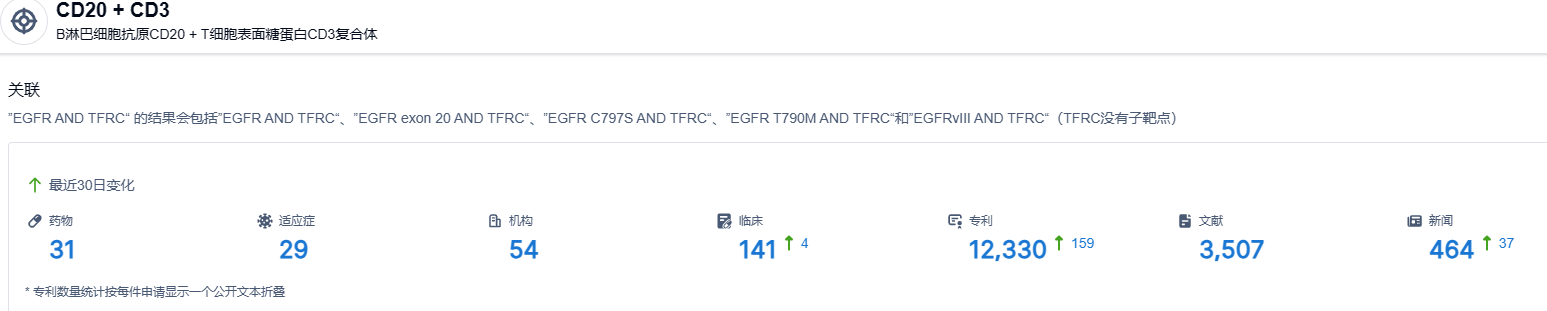
根据智慧芽新药情报库所披露的信息,截止到 2023 年6月17日,CD20 + CD3 靶点共有在研药物31个,包含的适应症有29种,在研机构54家,涉及相关的临床试验141件,专利多达12330件。。。Columvi的获批是给B细胞性淋巴瘤患者带来了新的治疗选择。